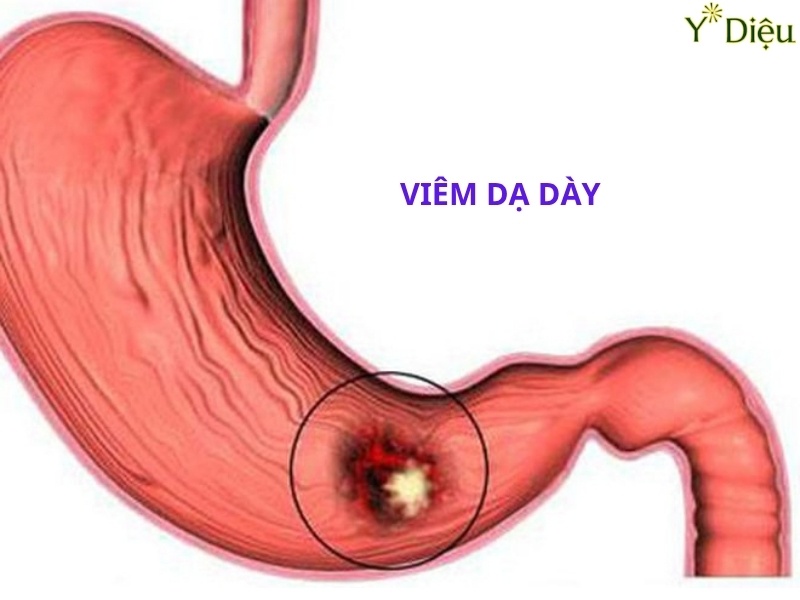
Vi Khuẩn HP Là Gì? Chúng Có Nguy Hiểm Gì Cho Dạ Dạy
Đặc điểm sinh học và cấu trúc của vi khuẩn HP
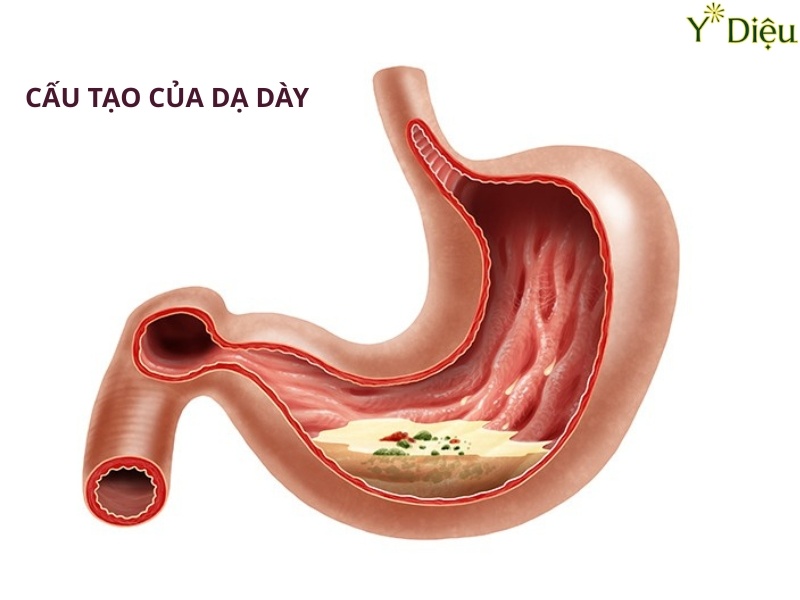
Helicobacter pylori (HP) là một loại vi khuẩn Gram âm, hình xoắn đặc trưng, thuộc họ Helicobacteraceae. Cấu trúc hình xoắn ốc của HP giúp vi khuẩn di chuyển dễ dàng xuyên qua lớp nhầy bảo vệ niêm mạc dạ dày, một môi trường có tính acid cao mà rất ít vi sinh vật có thể tồn tại. HP có kích thước trung bình từ 2,5-5,0 μm chiều dài và 0,5-1,0 μm chiều rộng, với 4-6 roi ở một đầu, tạo nên khả năng di động mạnh mẽ, giúp vi khuẩn tiếp cận và bám dính vào lớp biểu mô dạ dày.
Lớp vỏ ngoài của HP được cấu tạo bởi màng ngoài giàu lipopolysaccharide (LPS). LPS không chỉ đóng vai trò như một hàng rào vật lý bảo vệ vi khuẩn khỏi tác động của acid dạ dày mà còn giúp HP tránh được sự nhận diện và tấn công của hệ miễn dịch chủ. LPS của HP có cấu trúc đặc biệt, với các chuỗi oligosaccharide tương tự như các kháng nguyên nhóm máu của người, giúp vi khuẩn "ngụy trang" và hạn chế đáp ứng miễn dịch đặc hiệu.
Một trong những đặc điểm nổi bật nhất của HP là khả năng sản xuất enzyme urease với nồng độ rất cao. Urease xúc tác phản ứng phân giải urea thành amoniac (NH3) và carbon dioxide (CO2). Amoniac sinh ra sẽ trung hòa acid dạ dày xung quanh vi khuẩn, tạo ra một vùng vi môi trường kiềm hóa, giúp HP tồn tại và phát triển ngay cả trong điều kiện acid mạnh. Chính nhờ hoạt động của urease, HP có thể vượt qua hàng rào acid dạ dày mà không bị tiêu diệt.
Ngoài urease, HP còn tiết ra nhiều enzyme khác góp phần vào quá trình xâm nhập, tồn tại và gây bệnh:
- Catalase: Giúp phân giải hydrogen peroxide (H2O2), bảo vệ vi khuẩn khỏi stress oxy hóa do bạch cầu trung tính tạo ra.
- Phospholipase: Phá vỡ cấu trúc phospholipid của màng tế bào chủ, hỗ trợ quá trình xâm nhập và gây tổn thương niêm mạc.
- Protease: Tham gia phân giải protein của chất nền ngoại bào, làm suy yếu hàng rào bảo vệ của niêm mạc dạ dày.
Đặc biệt, HP sở hữu nhiều yếu tố độc lực quan trọng, đóng vai trò quyết định trong cơ chế gây bệnh và mức độ nghiêm trọng của tổn thương niêm mạc dạ dày:
- CagA (cytotoxin-associated gene A): Là một protein được mã hóa bởi gen cagA, nằm trong "đảo gen gây bệnh" (cag pathogenicity island). Khi HP xâm nhập vào niêm mạc dạ dày, CagA được tiêm trực tiếp vào tế bào biểu mô thông qua hệ thống tiết type IV (Type IV secretion system). CagA làm thay đổi cấu trúc tế bào, kích thích quá trình viêm, tăng sinh tế bào và có liên quan mật thiết đến nguy cơ ung thư dạ dày.
- VacA (vacuolating cytotoxin A): Là một ngoại độc tố có khả năng tạo các không bào (vacuole) trong tế bào chủ, gây rối loạn chức năng tế bào, thúc đẩy quá trình chết tế bào theo chương trình (apoptosis) và làm tổn thương hàng rào bảo vệ niêm mạc.
- BabA (Blood group antigen-binding adhesin): Là một protein bám dính, cho phép HP gắn kết chặt chẽ vào các thụ thể Lewis b trên bề mặt tế bào biểu mô dạ dày, tăng khả năng định cư và tồn tại lâu dài.
- OipA (Outer inflammatory protein A): Thúc đẩy quá trình viêm thông qua kích thích sản xuất các cytokine tiền viêm như IL-8, góp phần vào cơ chế viêm mạn tính của niêm mạc dạ dày.
Sự phối hợp giữa các enzyme và yếu tố độc lực này tạo nên khả năng thích nghi, xâm nhập và gây bệnh mạnh mẽ của HP. Đặc biệt, sự hiện diện của các chủng HP mang gen cagA và vacA độc tính cao thường liên quan đến các biến chứng nặng như viêm dạ dày mạn tính, loét dạ dày-tá tràng, thậm chí ung thư dạ dày.
Về mặt cấu trúc, vi khuẩn HP có các đặc điểm nổi bật sau:
- Thành tế bào Gram âm: Gồm 3 lớp: màng ngoài (outer membrane), lớp peptidoglycan mỏng và màng trong (inner membrane). Màng ngoài chứa LPS, các protein màng ngoài (OMP), giúp vi khuẩn bám dính và tránh hệ miễn dịch.
- Roi (flagella): 4-6 roi ở một đầu, cấu tạo từ protein flagellin, giúp HP di chuyển linh hoạt trong lớp nhầy dạ dày.
- Capsule (vỏ bọc polysaccharide): Một số chủng HP có lớp vỏ polysaccharide mỏng, hỗ trợ bảo vệ khỏi thực bào và tăng khả năng sống sót.
- Plasmid: Một số chủng HP mang plasmid, chứa các gen liên quan đến kháng kháng sinh hoặc yếu tố độc lực bổ sung.
Bảng: Một số đặc điểm cấu trúc và chức năng chính của vi khuẩn HP
| Thành phần | Chức năng |
|---|---|
| Roi (Flagella) | Di chuyển trong lớp nhầy dạ dày, giúp xâm nhập niêm mạc |
| LPS (Lipopolysaccharide) | Bảo vệ khỏi acid và hệ miễn dịch, ngụy trang kháng nguyên |
| Urease | Trung hòa acid dạ dày, tạo môi trường sống thuận lợi |
| CagA | Gây biến đổi tế bào, tăng nguy cơ ung thư |
| VacA | Gây tổn thương tế bào, thúc đẩy viêm loét |
| BabA, OipA | Bám dính, kích thích viêm |
Ngoài ra, HP còn có khả năng biến đổi hình thái từ dạng xoắn sang dạng cầu (coccoid) khi gặp điều kiện bất lợi như thiếu dinh dưỡng, tiếp xúc với kháng sinh hoặc môi trường acid quá cao. Dạng cầu này giúp HP tồn tại dai dẳng trong dạ dày, góp phần vào hiện tượng tái phát sau điều trị.
HP cũng có hệ gen đa dạng, với hơn 1.600 gen mã hóa cho nhiều loại protein khác nhau, trong đó có nhiều gen liên quan đến khả năng thích nghi, kháng kháng sinh và độc lực. Sự biến đổi di truyền liên tục giúp HP dễ dàng thích nghi với môi trường dạ dày biến động và kháng lại các biện pháp điều trị.
Tóm lại, Helicobacter pylori là một vi khuẩn có cấu trúc phức tạp, khả năng thích nghi và gây bệnh mạnh mẽ nhờ sự phối hợp giữa các enzyme, yếu tố độc lực và đặc điểm cấu trúc độc đáo. Hiểu rõ các đặc điểm này là nền tảng quan trọng cho việc chẩn đoán, điều trị và phòng ngừa các bệnh lý liên quan đến HP.
Cơ chế lây nhiễm và tồn tại của vi khuẩn HP trong dạ dày
Helicobacter pylori (HP) là một loại vi khuẩn Gram âm, hình xoắn, có khả năng sinh tồn đặc biệt trong môi trường acid khắc nghiệt của dạ dày người. Sự lây nhiễm và tồn tại của HP trong dạ dày là một quá trình phức tạp, liên quan đến nhiều yếu tố vi sinh học, miễn dịch học và sinh lý học của cả vi khuẩn lẫn vật chủ.
Con đường lây nhiễm chính của vi khuẩn HP
HP chủ yếu lây truyền qua hai con đường:
- Đường phân-miệng: Vi khuẩn có thể được đào thải qua phân của người nhiễm, sau đó lây lan qua nguồn nước, thực phẩm hoặc tay bị nhiễm bẩn. Đây là con đường lây nhiễm phổ biến ở các quốc gia đang phát triển, nơi điều kiện vệ sinh còn hạn chế.
- Đường miệng-miệng: Lây truyền qua nước bọt, dịch tiết miệng khi dùng chung đồ dùng cá nhân, ăn uống chung hoặc tiếp xúc gần gũi. HP đã được phát hiện trong mảng bám răng, nước bọt, và dịch dạ dày.
Ngoài ra, một số nghiên cứu còn ghi nhận khả năng lây nhiễm qua dụng cụ y tế không được tiệt trùng đúng cách, tuy nhiên tỷ lệ này thấp hơn nhiều so với hai con đường trên.
Cơ chế xâm nhập và thích nghi trong dạ dày
Sau khi xâm nhập vào cơ thể, HP phải đối mặt với môi trường acid mạnh của dạ dày (pH 1-2). Để vượt qua hàng rào này, HP sử dụng các đặc điểm sinh học nổi bật:
- Khả năng di động nhờ roi: HP có 4-6 roi ở một đầu, giúp vi khuẩn di chuyển linh hoạt trong lớp nhầy bảo vệ niêm mạc dạ dày. Nhờ đó, HP có thể xuyên qua lớp chất nhầy dày đặc, tiến sát đến lớp biểu mô dạ dày – nơi có pH trung tính hơn, thuận lợi cho sự sống còn.
- Bám dính vào tế bào biểu mô: HP sử dụng các protein bề mặt đặc hiệu để bám chặt vào tế bào biểu mô dạ dày. Hai protein quan trọng nhất là BabA (blood group antigen binding adhesin) – gắn với kháng nguyên nhóm máu Lewis b trên bề mặt tế bào, và SabA (sialic acid-binding adhesin) – gắn với các cấu trúc chứa acid sialic. Sự bám dính này giúp HP tránh bị đào thải bởi nhu động dạ dày và dịch tiêu hóa.
Các yếu tố giúp vi khuẩn HP tồn tại và phát triển trong dạ dày
Để thích nghi và tồn tại lâu dài trong môi trường dạ dày, HP phát triển nhiều cơ chế sinh tồn đặc biệt:
- Enzyme urease: Đây là yếu tố then chốt giúp HP trung hòa acid dạ dày. Urease phân giải urea thành ammonia và carbon dioxide. Ammonia có tính kiềm, giúp tạo ra một vùng vi môi trường trung tính xung quanh vi khuẩn, bảo vệ HP khỏi tác động của acid. Ngoài ra, ammonia còn gây tổn thương tế bào biểu mô, góp phần vào quá trình viêm loét.
- Khả năng biến đổi kháng nguyên: HP có thể thay đổi cấu trúc các phân tử kháng nguyên trên bề mặt (như lipopolysaccharide, protein ngoài màng), giúp tránh né sự nhận diện và tấn công của hệ miễn dịch vật chủ. Sự biến đổi này còn góp phần làm cho việc phát triển vaccine phòng ngừa HP gặp nhiều khó khăn.
- Hình thành màng sinh học (biofilm): vi khuẩn HP có khả năng tạo biofilm – một lớp màng sinh học bảo vệ gồm polysaccharide, protein và DNA ngoại bào. Biofilm giúp HP bám dính vững chắc vào bề mặt niêm mạc, tăng khả năng chống lại tác động của kháng sinh và các yếu tố miễn dịch. Biofilm còn là nguyên nhân khiến việc điều trị HP kéo dài và dễ tái phát.
- Hệ thống tiết Type IV (Type IV secretion system – T4SS): Đây là hệ thống protein phức tạp giúp HP tiêm các yếu tố độc lực (như CagA) vào tế bào chủ, làm thay đổi cấu trúc và chức năng của tế bào biểu mô, thúc đẩy quá trình viêm mạn tính và tăng nguy cơ ung thư dạ dày.
- Khả năng điều hòa gen thích nghi: HP có bộ gen biến đổi linh hoạt, cho phép thích nghi nhanh với các thay đổi của môi trường dạ dày, như nồng độ acid, oxy, chất dinh dưỡng và áp lực miễn dịch.
Tác động của vi khuẩn HP lên niêm mạc dạ dày
Sự tồn tại lâu dài của HP trên niêm mạc dạ dày gây ra nhiều hậu quả nghiêm trọng:
- Gây viêm mạn tính: HP kích thích tế bào miễn dịch tiết cytokine gây viêm (như IL-8), làm tổn thương niêm mạc và thúc đẩy quá trình viêm loét.
- Thay đổi cấu trúc tế bào biểu mô: Các yếu tố độc lực như CagA, VacA làm rối loạn chức năng tế bào, tăng nguy cơ dị sản, loạn sản và ung thư hóa.
- Ức chế cơ chế bảo vệ tự nhiên: HP làm giảm tiết chất nhầy, bicarbonate và các yếu tố bảo vệ khác, khiến niêm mạc dễ bị tổn thương bởi acid và pepsin.
Bảng: Các yếu tố chính giúp vi khuẩn HP tồn tại trong dạ dày
| Yếu tố | Vai trò |
|---|---|
| Roi di động | Giúp HP xuyên qua lớp nhầy, tiếp cận biểu mô |
| BabA, SabA | Bám dính vào tế bào biểu mô dạ dày |
| Urease | Trung hòa acid, tạo môi trường sống thuận lợi |
| Biến đổi kháng nguyên | Tránh né hệ miễn dịch |
| Biofilm | Bảo vệ khỏi kháng sinh và miễn dịch |
| T4SS | Tiêm độc tố vào tế bào chủ, thúc đẩy viêm |
Ý nghĩa lâm sàng của cơ chế tồn tại HP
Sự phức tạp trong cơ chế tồn tại của HP là nguyên nhân khiến việc điều trị tiệt trừ vi khuẩn này gặp nhiều thách thức. HP có thể kháng lại nhiều loại kháng sinh nhờ biofilm, biến đổi kháng nguyên và khả năng thích nghi di truyền. Ngoài ra, sự tồn tại kéo dài của HP còn làm tăng nguy cơ tái phát sau điều trị, cũng như nguy cơ tiến triển thành các bệnh lý nặng như loét dạ dày-tá tràng, ung thư dạ dày và lymphoma niêm mạc (MALT lymphoma).
Việc hiểu rõ các cơ chế lây nhiễm và tồn tại của HP là nền tảng để phát triển các chiến lược phòng ngừa, chẩn đoán và điều trị hiệu quả hơn trong tương lai.
Yếu tố độc lực và cơ chế gây bệnh của vi khuẩn HP
Helicobacter pylori (HP) là một loại vi khuẩn Gram âm, hình xoắn, cư trú chủ yếu ở lớp nhầy phủ trên bề mặt niêm mạc dạ dày người. Khả năng gây bệnh của HP không chỉ dựa vào việc tồn tại trong môi trường acid khắc nghiệt mà còn phụ thuộc vào nhiều yếu tố độc lực đặc hiệu. Những yếu tố này giúp HP xâm nhập, tồn tại, gây tổn thương và kích hoạt các phản ứng viêm tại niêm mạc dạ dày, từ đó dẫn đến các bệnh lý như viêm dạ dày, loét dạ dày-tá tràng và ung thư dạ dày.
- CagA (Cytotoxin-associated gene A):
CagA là một trong những yếu tố độc lực quan trọng nhất của HP, được mã hóa bởi gen nằm trên "pathogenicity island" (PAI) gọi là cagPAI. Sau khi HP bám dính vào tế bào biểu mô dạ dày, hệ thống tiết type IV (Type IV Secretion System - T4SS) sẽ tiêm trực tiếp protein CagA vào bên trong tế bào chủ. Tại đây, CagA bị phosphoryl hóa bởi các kinase của tế bào chủ, sau đó tương tác với nhiều protein nội bào, gây ra hàng loạt thay đổi:
- Thay đổi hình thái tế bào: CagA làm rối loạn bộ xương tế bào (cytoskeleton), gây hiện tượng “hummingbird phenotype” – tế bào kéo dài bất thường, mất liên kết chặt chẽ, tạo điều kiện cho sự xâm lấn và di căn.
- Kích hoạt tín hiệu viêm: CagA thúc đẩy hoạt hóa các con đường tín hiệu như NF-κB, MAPK, dẫn tới tăng sản xuất cytokine (IL-8, TNF-α), thu hút bạch cầu đa nhân, làm trầm trọng quá trình viêm mạn tính.
- Rối loạn kiểm soát tế bào: CagA ảnh hưởng đến các protein điều hòa chu kỳ tế bào, ức chế quá trình chết theo chương trình (apoptosis), tăng sinh tế bào bất thường, từ đó tăng nguy cơ chuyển dạng ác tính và hình thành ung thư dạ dày.
Sự hiện diện của CagA là dấu hiệu cho thấy chủng HP có độc lực cao, liên quan chặt chẽ đến các thể bệnh nặng như viêm teo niêm mạc, dị sản ruột và ung thư biểu mô tuyến dạ dày.
- VacA (Vacuolating cytotoxin A):
VacA là một ngoại độc tố được tiết ra bởi HP, có khả năng gây độc trực tiếp lên tế bào biểu mô dạ dày. Đặc điểm nổi bật của VacA là tạo ra các không bào lớn (vacuole) trong bào tương tế bào chủ, dẫn đến rối loạn chức năng tế bào. Cơ chế tác động của VacA bao gồm:
- Hình thành không bào: VacA làm thay đổi tính thấm màng tế bào, gây tích tụ nước và ion, tạo các không bào lớn, phá vỡ cấu trúc tế bào.
- Ức chế chức năng miễn dịch: VacA có thể ức chế hoạt động của tế bào lympho T, làm giảm đáp ứng miễn dịch tại chỗ, giúp HP tồn tại lâu dài trong dạ dày.
- Thúc đẩy quá trình viêm loét: VacA kích thích tiết IL-8, tăng bạch cầu đa nhân, làm tổn thương lớp niêm mạc, thúc đẩy quá trình viêm loét tiến triển.
- Gây chết tế bào theo chương trình (apoptosis): VacA có thể kích hoạt các con đường gây chết tế bào, làm mất cân bằng giữa tái tạo và hủy hoại niêm mạc.
Các biến thể gen của VacA (s1/m1, s1/m2, s2/m1, s2/m2) quyết định mức độ độc lực, trong đó chủng mang s1/m1 có khả năng gây bệnh mạnh nhất.
- Enzyme urease, protease, phospholipase:
- Urease: Đây là enzyme đặc trưng của HP, xúc tác phân hủy urea thành amoniac và CO2. Amoniac giúp trung hòa acid dạ dày xung quanh vi khuẩn, tạo môi trường thuận lợi cho HP sống sót. Tuy nhiên, amoniac cũng là chất độc, gây tổn thương trực tiếp tế bào biểu mô và góp phần vào quá trình viêm loét.
- Protease: Các enzyme này phân giải protein của chất nhầy bảo vệ niêm mạc, làm giảm độ nhớt và khả năng bảo vệ của lớp nhầy, tạo điều kiện cho acid và các yếu tố gây viêm tiếp xúc trực tiếp với tế bào biểu mô.
- Phospholipase: Phospholipase phá hủy các phospholipid màng tế bào, làm tăng tính thấm của niêm mạc, góp phần vào quá trình tổn thương và viêm loét.
Sự phối hợp của các enzyme này không chỉ giúp HP vượt qua hàng rào bảo vệ tự nhiên của dạ dày mà còn tạo điều kiện cho các yếu tố độc lực khác phát huy tác dụng, làm trầm trọng thêm tổn thương niêm mạc.
Cơ chế gây bệnh tổng thể của vi khuẩn HP
Quá trình gây bệnh của HP là kết quả của sự phối hợp phức tạp giữa các yếu tố độc lực của vi khuẩn và đáp ứng miễn dịch của vật chủ. Sau khi xâm nhập, HP bám dính vào tế bào biểu mô dạ dày thông qua các adhesin như BabA, SabA, OipA, giúp vi khuẩn cố định vững chắc tại vị trí tổn thương. Tại đây, HP tiết ra các yếu tố độc lực (CagA, VacA) và enzyme (urease, protease, phospholipase), phá vỡ hàng rào bảo vệ niêm mạc, kích hoạt các con đường viêm, làm tổn thương tế bào biểu mô, thúc đẩy quá trình chết tế bào và rối loạn chức năng miễn dịch.
Đáp ứng viêm kéo dài dẫn đến tổn thương mạn tính, teo niêm mạc, dị sản ruột và tăng nguy cơ ung thư hóa. Ngoài ra, sự đa dạng di truyền của HP (đa dạng các gen độc lực, biến thể adhesin) cũng góp phần giải thích vì sao cùng một chủng HP nhưng mức độ tổn thương và biểu hiện lâm sàng lại khác nhau giữa các cá thể.
Bảng: Một số yếu tố độc lực chính của vi khuẩn HP và vai trò trong bệnh sinh
| Yếu tố độc lực | Chức năng chính | Hậu quả bệnh lý |
|---|---|---|
| CagA | Tiêm vào tế bào chủ, thay đổi tín hiệu nội bào, kích hoạt viêm, rối loạn kiểm soát tế bào | Viêm mạn tính, dị sản, tăng nguy cơ ung thư dạ dày |
| VacA | Tạo không bào, ức chế miễn dịch, gây chết tế bào | Tổn thương niêm mạc, viêm loét, suy giảm miễn dịch tại chỗ |
| Urease | Trung hòa acid, tạo môi trường sống cho HP | Tổn thương tế bào, tăng viêm loét |
| Protease, Phospholipase | Phá hủy chất nhầy và màng tế bào | Giảm bảo vệ niêm mạc, tăng nguy cơ tổn thương |
Một số yếu tố độc lực khác của vi khuẩn HP
- BabA (Blood group antigen-binding adhesin): Giúp HP bám dính vào kháng nguyên nhóm máu Lewis b trên bề mặt tế bào biểu mô dạ dày, tăng khả năng định cư và gây bệnh.
- SabA (Sialic acid-binding adhesin): Bám vào các cấu trúc chứa acid sialic, đặc biệt quan trọng trong viêm dạ dày mạn tính và loét.
- OipA (Outer inflammatory protein A): Tăng cường đáp ứng viêm, liên quan đến mức độ nặng của viêm dạ dày.
- DupA (Duodenal ulcer promoting gene A): Liên quan đến tăng nguy cơ loét tá tràng, có thể kích thích tiết IL-8 mạnh mẽ.
Ảnh hưởng của yếu tố vật chủ và môi trường
Mức độ tổn thương do HP gây ra còn phụ thuộc vào yếu tố di truyền của vật chủ (đa hình gen IL-1β, TNF-α, IL-10...), chế độ ăn uống, hút thuốc lá, stress và các yếu tố môi trường khác. Sự tương tác giữa độc lực vi khuẩn, đáp ứng miễn dịch và yếu tố môi trường quyết định nguy cơ tiến triển từ nhiễm HP không triệu chứng đến viêm loét hoặc ung thư dạ dày.
Sự phối hợp giữa các yếu tố độc lực này cùng với đáp ứng miễn dịch của cơ thể dẫn đến các tổn thương như viêm dạ dày, loét dạ dày-tá tràng, thậm chí là ung thư dạ dày.Chẩn đoán vi khuẩn vi khuẩn HP dạ dày
Helicobacter pylori (HP) là một loại vi khuẩn gram âm, sống chủ yếu ở lớp nhầy niêm mạc dạ dày người. Việc phát hiện và chẩn đoán HP đóng vai trò quan trọng trong điều trị các bệnh lý dạ dày như viêm loét dạ dày-tá tràng, ung thư dạ dày. Hiện nay, các phương pháp chẩn đoán HP được chia thành hai nhóm chính: xâm lấn và không xâm lấn, mỗi nhóm có ưu nhược điểm và chỉ định riêng biệt.
1. Xét nghiệm xâm lấn
Xét nghiệm xâm lấn yêu cầu can thiệp nội soi để lấy mẫu mô dạ dày, thường được chỉ định khi bệnh nhân có triệu chứng nghi ngờ tổn thương thực thể hoặc cần đánh giá tổn thương niêm mạc. Các kỹ thuật chuyên sâu bao gồm:
- Nội soi sinh thiết dạ dày
- Nhuộm Gram và nhuộm đặc biệt: Mẫu mô sinh thiết được nhuộm Gram hoặc nhuộm Giemsa, Warthin-Starry để quan sát trực tiếp vi khuẩn HP dưới kính hiển vi. Phương pháp này cho phép đánh giá hình thái và mật độ vi khuẩn, đồng thời khảo sát tổn thương mô học liên quan như viêm, dị sản, loạn sản.
- Nuôi cấy vi khuẩn HP: Mẫu mô được nuôi cấy trên môi trường chọn lọc đặc biệt. Đây là tiêu chuẩn vàng để xác định HP, đồng thời cho phép làm kháng sinh đồ, đánh giá tình trạng kháng thuốc. Tuy nhiên, nuôi cấy đòi hỏi điều kiện phòng lab nghiêm ngặt, thời gian kéo dài (3-7 ngày), độ nhạy thấp do vi khuẩn khó nuôi cấy.
- Xét nghiệm urease nhanh (CLO test): Dựa trên khả năng tiết men urease mạnh của HP, mẫu mô sinh thiết được đặt vào môi trường chứa urea và chỉ thị màu. Nếu có HP, urease phân giải urea tạo ra amoniac, làm đổi màu chỉ thị. Kết quả có thể đọc sau 1-24 giờ. Phương pháp này có độ nhạy và đặc hiệu cao, chi phí thấp, cho kết quả nhanh.
- Phản ứng PCR (Polymerase Chain Reaction)
- PCR là kỹ thuật khuếch đại đoạn DNA đặc hiệu của HP từ mô sinh thiết. Phương pháp này có độ nhạy và đặc hiệu rất cao, phát hiện được cả lượng vi khuẩn rất nhỏ hoặc các chủng kháng thuốc. Ngoài ra, PCR còn giúp xác định các đột biến gen liên quan đến kháng kháng sinh (như clarithromycin, levofloxacin), hỗ trợ lựa chọn phác đồ điều trị tối ưu.

2. Xét nghiệm không xâm lấn
Các xét nghiệm không xâm lấn được ưu tiên sử dụng trong tầm soát, chẩn đoán ban đầu hoặc đánh giá hiệu quả điều trị vi khuẩn HP, đặc biệt ở những bệnh nhân không có chỉ định nội soi. Một số kỹ thuật phổ biến và chuyên sâu:
- Test hơi thở ure (Urea breath test - UBT)
- Bệnh nhân uống dung dịch urea gắn đồng vị carbon-13 (C13) hoặc carbon-14 (C14). Nếu có HP, men urease sẽ phân giải urea thành amoniac và CO2 chứa đồng vị, được hấp thu vào máu và thải ra qua phổi. Mẫu hơi thở được thu thập và phân tích bằng máy quang phổ khối hoặc máy đo phóng xạ. Đây là phương pháp không xâm lấn có độ nhạy và đặc hiệu cao nhất hiện nay (trên 95%), thích hợp cho cả trẻ em và người lớn, dùng để chẩn đoán nhiễm HP cũng như đánh giá tiệt trừ HP sau điều trị.
- Một số lưu ý: Bệnh nhân cần ngưng kháng sinh ít nhất 4 tuần, ngưng thuốc ức chế bơm proton (PPI) ít nhất 2 tuần trước khi làm test để tránh kết quả âm tính giả.
- Xét nghiệm kháng nguyên HP trong phân (Stool Antigen Test)
- Sử dụng kỹ thuật miễn dịch enzyme (ELISA) hoặc miễn dịch sắc ký để phát hiện kháng nguyên HP trong mẫu phân. Phương pháp này không xâm lấn, dễ thực hiện, chi phí hợp lý, phù hợp cho trẻ nhỏ, người già, phụ nữ mang thai. Độ nhạy và đặc hiệu tương đương UBT nếu thực hiện đúng quy trình.
- Cần lưu ý: Kết quả có thể bị ảnh hưởng nếu bệnh nhân đang dùng kháng sinh, bismuth hoặc PPI.
- Xét nghiệm huyết thanh học (Serology)
- Phát hiện kháng thể IgG kháng HP trong huyết thanh bằng kỹ thuật ELISA hoặc miễn dịch điện hóa phát quang. Ưu điểm là không xâm lấn, dễ thực hiện, chi phí thấp. Tuy nhiên, nhược điểm lớn là không phân biệt được nhiễm HP hiện tại hay đã từng nhiễm trong quá khứ, do kháng thể tồn tại lâu sau khi đã tiệt trừ HP.
- Xét nghiệm này phù hợp cho mục đích tầm soát cộng đồng hoặc khi các phương pháp khác không khả thi.
3. So sánh các phương pháp chẩn đoán HP
| Phương pháp | Độ nhạy (%) | Độ đặc hiệu (%) | Ưu điểm | Nhược điểm |
|---|---|---|---|---|
| Nội soi sinh thiết + CLO test | 85-95 | 95-100 | Chẩn đoán trực tiếp, đánh giá tổn thương mô học | Xâm lấn, phụ thuộc vị trí lấy mẫu |
| Nuôi cấy HP | 60-80 | 100 | Tiêu chuẩn vàng, làm kháng sinh đồ | Khó thực hiện, thời gian lâu |
| PCR | 95-100 | 95-100 | Độ nhạy rất cao, phát hiện kháng thuốc | Chi phí cao, cần labo chuyên sâu |
| Test hơi thở ure | 95-98 | 95-98 | Không xâm lấn, kết quả nhanh | Bị ảnh hưởng bởi thuốc, chi phí cao |
| Kháng nguyên phân | 90-95 | 90-95 | Không xâm lấn, phù hợp trẻ em | Bị ảnh hưởng bởi thuốc, mẫu phân |
| Huyết thanh học | 80-90 | 80-90 | Không xâm lấn, chi phí thấp | Không phân biệt nhiễm cũ/mới |
4. Lựa chọn phương pháp chẩn đoán HP trong thực hành lâm sàng
- Bệnh nhân có triệu chứng tiêu hóa, nghi ngờ tổn thương thực thể: Ưu tiên nội soi sinh thiết kết hợp CLO test, nhuộm mô học, PCR hoặc nuôi cấy nếu cần xác định kháng thuốc.
- Bệnh nhân không có triệu chứng cảnh báo, cần tầm soát hoặc đánh giá sau điều trị: Test hơi thở ure hoặc xét nghiệm kháng nguyên phân là lựa chọn tối ưu.
- Bệnh nhân không thể thực hiện các phương pháp trên: Xét nghiệm huyết thanh học có thể cân nhắc, nhưng cần lưu ý hạn chế về giá trị chẩn đoán nhiễm HP hiện tại.
- Trẻ em, phụ nữ mang thai, người già yếu: Ưu tiên các phương pháp không xâm lấn, đặc biệt là test hơi thở ure hoặc kháng nguyên phân.
5. Một số lưu ý khi chẩn đoán HP
- Ảnh hưởng của thuốc: Kháng sinh, bismuth, thuốc ức chế bơm proton (PPI) có thể làm giảm mật độ HP, gây âm tính giả ở các test hơi thở, kháng nguyên phân và CLO test. Cần ngưng các thuốc này trước khi làm xét nghiệm theo khuyến cáo.
- Chỉ định nội soi: Không phải tất cả bệnh nhân đều cần nội soi. Chỉ định nội soi khi có triệu chứng cảnh báo (sụt cân, nôn ra máu, thiếu máu, nuốt nghẹn, tiền sử gia đình ung thư dạ dày) hoặc thất bại điều trị HP nhiều lần.
- Chẩn đoán xác định: Nên phối hợp ít nhất 2 phương pháp khác nhau để tăng độ chính xác, đặc biệt trong các trường hợp nghi ngờ hoặc kết quả không điển hình.
Kháng thuốc và thách thức trong điều trị vi khuẩn HP
Helicobacter pylori (HP) là một trong những nguyên nhân chính gây viêm loét dạ dày-tá tràng và ung thư dạ dày. Tuy nhiên, việc điều trị HP ngày càng trở nên khó khăn do tình trạng kháng kháng sinh gia tăng trên toàn cầu. Sự kháng thuốc này không chỉ làm giảm hiệu quả điều trị mà còn làm tăng nguy cơ tái phát bệnh, kéo dài thời gian điều trị và tăng chi phí y tế. Đặc biệt, tại Việt Nam, tỷ lệ kháng với các kháng sinh chủ lực như clarithromycin, metronidazole, levofloxacin đang ở mức báo động.
Thực trạng kháng thuốc của HP
Theo nhiều nghiên cứu dịch tễ học, tỷ lệ kháng clarithromycin của HP tại một số khu vực ở châu Á, trong đó có Việt Nam, đã vượt quá 30%. Tỷ lệ kháng metronidazole thậm chí còn cao hơn, dao động từ 40-70%. Kháng levofloxacin cũng ngày càng phổ biến, trong khi kháng amoxicillin và tetracycline vẫn còn thấp nhưng có xu hướng tăng dần. Sự đa kháng (kháng nhiều loại kháng sinh cùng lúc) khiến các phác đồ điều trị chuẩn ngày càng kém hiệu quả.
Cơ chế kháng thuốc của vi khuẩn HP
- Đột biến gen đích: HP có khả năng xuất hiện các đột biến tại vị trí gen mã hóa cho ribosome hoặc các enzyme đích của kháng sinh. Ví dụ, đột biến gen 23S rRNA làm giảm ái lực của clarithromycin với ribosome, khiến thuốc không còn khả năng ức chế tổng hợp protein của vi khuẩn. Đột biến gen gyrA và gyrB liên quan đến kháng levofloxacin, trong khi đột biến gen rdxA, frxA liên quan đến kháng metronidazole.
- Bơm đẩy thuốc ra ngoài tế bào (Efflux pump): HP tăng cường biểu hiện các bơm efflux như hefA, hefB, hefC, giúp loại bỏ kháng sinh ra khỏi tế bào vi khuẩn trước khi chúng kịp phát huy tác dụng. Cơ chế này không đặc hiệu cho một loại kháng sinh nào mà có thể gây kháng chéo nhiều nhóm thuốc khác nhau.
- Hình thành biofilm (màng sinh học): HP có khả năng tạo màng sinh học bao quanh tập hợp vi khuẩn, giúp chúng tránh khỏi tác động của kháng sinh và hệ miễn dịch. Biofilm làm giảm nồng độ kháng sinh tiếp cận vi khuẩn, đồng thời tạo môi trường thuận lợi cho sự trao đổi gen kháng thuốc giữa các chủng HP.
- Thay đổi tính thấm màng tế bào: Một số chủng HP có thể giảm tính thấm của màng tế bào đối với kháng sinh, đặc biệt là các kháng sinh nhóm beta-lactam, làm giảm hiệu quả điều trị.
- Enzyme bất hoạt kháng sinh: HP có thể sản xuất các enzyme như beta-lactamase, phân hủy hoặc bất hoạt kháng sinh trước khi chúng tác động lên vi khuẩn.
Hậu quả của kháng thuốc vi khuẩn HP
- Giảm hiệu quả điều trị: Tỷ lệ tiệt trừ HP thành công giảm mạnh, đặc biệt với các phác đồ cổ điển dựa trên clarithromycin hoặc metronidazole.
- Tăng nguy cơ tái phát: Bệnh nhân dễ bị tái nhiễm hoặc tái phát viêm loét dạ dày-tá tràng, kéo theo nguy cơ tiến triển thành ung thư dạ dày.
- Kéo dài thời gian điều trị: Bệnh nhân phải sử dụng nhiều phác đồ thay thế, thời gian điều trị kéo dài, tăng nguy cơ tác dụng phụ.
- Tăng chi phí y tế: Việc sử dụng các thuốc đắt tiền hơn, phối hợp nhiều loại thuốc và xét nghiệm kiểm tra sau điều trị làm tăng gánh nặng kinh tế cho người bệnh và hệ thống y tế.
Thách thức trong lựa chọn phác đồ điều trị
Sự gia tăng kháng thuốc buộc các bác sĩ phải cân nhắc kỹ lưỡng khi lựa chọn phác đồ điều trị HP. Các phác đồ cổ điển như bộ ba (clarithromycin, amoxicillin/metronidazole, PPI) dần mất hiệu quả ở những vùng có tỷ lệ kháng clarithromycin >15%. Các phác đồ thay thế như bộ bốn có bismuth, bộ bốn không bismuth, phác đồ nối tiếp, phác đồ cứu vãn với levofloxacin, rifabutin... được sử dụng nhưng cũng đối mặt với nguy cơ kháng thuốc chéo.
- Thiếu xét nghiệm kháng sinh đồ: Ở nhiều cơ sở y tế, việc làm kháng sinh đồ HP chưa phổ biến do chi phí cao, kỹ thuật phức tạp, dẫn đến điều trị chủ yếu dựa vào kinh nghiệm và tỷ lệ kháng thuốc tại địa phương.
- Tuân thủ điều trị kém: Bệnh nhân thường bỏ dở liệu trình do tác dụng phụ hoặc do phải uống nhiều loại thuốc cùng lúc, làm tăng nguy cơ kháng thuốc.
- Thiếu thuốc mới: Trong nhiều năm qua, rất ít kháng sinh mới được phát triển dành riêng cho HP, khiến lựa chọn điều trị ngày càng hạn chế.
Giải pháp kiểm soát kháng thuốc HP
- Giám sát và cập nhật tỷ lệ kháng thuốc: Cần thực hiện các nghiên cứu dịch tễ học thường xuyên để cập nhật tỷ lệ kháng thuốc tại từng địa phương, từ đó lựa chọn phác đồ phù hợp.
- Áp dụng xét nghiệm kháng sinh đồ: Khi có điều kiện, nên thực hiện nuôi cấy và làm kháng sinh đồ HP trước điều trị, đặc biệt ở các trường hợp thất bại với phác đồ đầu tay.
- Tăng cường giáo dục và tuân thủ điều trị: Hướng dẫn bệnh nhân tuân thủ đầy đủ phác đồ, không tự ý ngưng thuốc hoặc dùng lại đơn cũ khi chưa có chỉ định của bác sĩ.
- Phát triển phác đồ mới: Nghiên cứu các phác đồ phối hợp mới, sử dụng các thuốc bổ trợ như bismuth, probiotics, hoặc các kháng sinh ít bị kháng như furazolidone, rifabutin.
- Kiểm soát sử dụng kháng sinh: Hạn chế lạm dụng kháng sinh trong cộng đồng, đặc biệt là các kháng sinh phổ rộng, nhằm giảm áp lực chọn lọc kháng thuốc.
Xu hướng nghiên cứu và điều trị HP trong tương lai
- Liệu pháp cá thể hóa: Dựa trên kết quả kháng sinh đồ, genotypic resistance testing, hoặc các chỉ điểm sinh học để lựa chọn phác đồ tối ưu cho từng bệnh nhân.
- Ứng dụng công nghệ sinh học: Sử dụng các peptide kháng khuẩn, enzyme phân hủy biofilm, hoặc liệu pháp miễn dịch nhằm tăng hiệu quả tiệt trừ HP mà không phụ thuộc hoàn toàn vào kháng sinh truyền thống.
- Vaccine phòng ngừa HP: Dù còn đang trong giai đoạn thử nghiệm, vaccine phòng HP được kỳ vọng sẽ là giải pháp lâu dài để kiểm soát lây nhiễm và giảm gánh nặng bệnh tật.
- Phối hợp probiotics: Một số nghiên cứu cho thấy bổ sung probiotics có thể hỗ trợ giảm tác dụng phụ của kháng sinh, tăng tỷ lệ tiệt trừ HP và hạn chế sự phát triển của chủng kháng thuốc.
Bảng: Tỷ lệ kháng kháng sinh của vi khuẩn HP tại một số khu vực
| Kháng sinh | Tỷ lệ kháng tại Việt Nam (%) | Tỷ lệ kháng tại châu Á (%) | Tỷ lệ kháng tại châu Âu (%) |
|---|---|---|---|
| Clarithromycin | 30-40 | 20-40 | 10-20 |
| Metronidazole | 50-70 | 40-70 | 20-40 |
| Levofloxacin | 10-20 | 10-25 | 5-15 |
| Amoxicillin | <5 | <5 | <5 |
Khuyến nghị thực hành lâm sàng
- Chọn phác đồ dựa trên tỷ lệ kháng thuốc địa phương: Ở những nơi có tỷ lệ kháng clarithromycin cao, ưu tiên phác đồ bộ bốn có bismuth hoặc phác đồ nối tiếp.
- Kiểm tra tiệt trừ HP sau điều trị: Sử dụng test hơi thở ure hoặc xét nghiệm phân để đánh giá hiệu quả, tránh lạm dụng nội soi.
- Không tự ý dùng lại phác đồ đã thất bại: Nếu điều trị thất bại, cần chuyển sang phác đồ cứu vãn dựa trên kháng sinh đồ hoặc kinh nghiệm.
- Giáo dục cộng đồng về nguy cơ kháng thuốc: Nâng cao nhận thức về việc sử dụng kháng sinh hợp lý, phòng ngừa lây nhiễm HP qua vệ sinh ăn uống và môi trường.
Ảnh hưởng của vi khuẩn HP đến sức khỏe dạ dày và toàn thân
Helicobacter pylori (HP) là một loại vi khuẩn gram âm, hình xoắn, có khả năng sinh sống và phát triển mạnh mẽ trong môi trường acid của dạ dày nhờ enzyme urease. Sự hiện diện kéo dài của HP trong dạ dày không chỉ gây ra các bệnh lý tại chỗ mà còn ảnh hưởng sâu rộng đến sức khỏe toàn thân thông qua nhiều cơ chế phức tạp.
1. Tác động của vi khuẩn HP lên dạ dày
- Viêm dạ dày mạn tính: HP là nguyên nhân hàng đầu gây viêm dạ dày mạn tính. Vi khuẩn này xâm nhập vào lớp nhầy bảo vệ niêm mạc, tiết ra các độc tố như VacA, CagA, kích hoạt phản ứng viêm kéo dài. Quá trình này làm tổn thương tế bào biểu mô, dẫn đến viêm teo niêm mạc, rối loạn chức năng tiết acid và enzyme tiêu hóa.
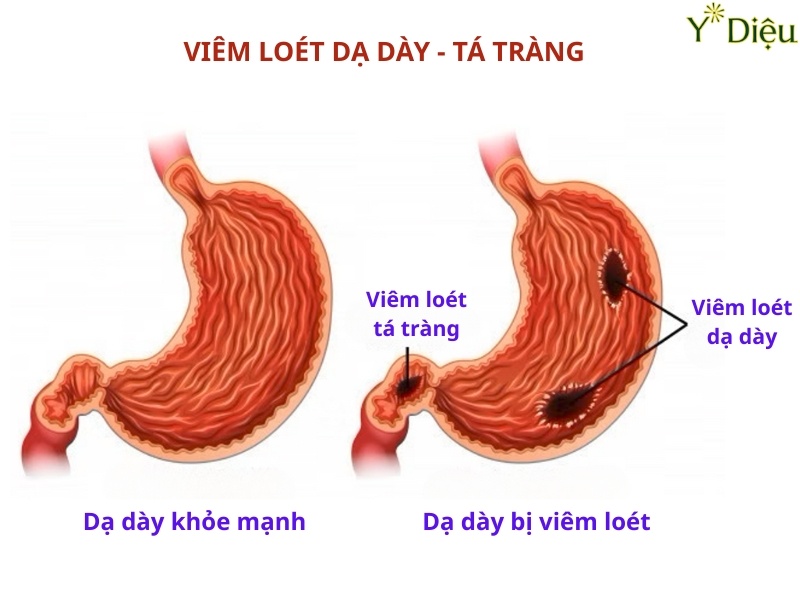
- Loét dạ dày-tá tràng: HP làm suy yếu hàng rào bảo vệ niêm mạc, tăng tiết acid hoặc làm giảm khả năng trung hòa acid, tạo điều kiện hình thành ổ loét. Khoảng 70-90% các trường hợp loét dạ dày-tá tràng có liên quan đến HP.
- Ung thư dạ dày: HP được Tổ chức Y tế Thế giới (WHO) xếp vào nhóm tác nhân gây ung thư loại I. Quá trình viêm mạn tính kéo dài do HP thúc đẩy sự biến đổi dị sản ruột, loạn sản và cuối cùng là ung thư biểu mô tuyến dạ dày. Nguy cơ ung thư tăng cao ở những bệnh nhân nhiễm chủng HP mang gen CagA.
- Lymphoma MALT dạ dày: HP còn liên quan đến sự phát triển của u lympho mô lympho liên kết niêm mạc (MALT lymphoma), một dạng ung thư hiếm gặp nhưng có thể thuyên giảm khi điều trị tiệt trừ HP.
2. Ảnh hưởng ngoài dạ dày của vi khuẩn HP
- Thiếu máu thiếu sắt: HP làm giảm hấp thu sắt qua niêm mạc dạ dày bị tổn thương, đồng thời cạnh tranh hấp thu sắt với cơ thể. Ngoài ra, tình trạng viêm mạn tính làm tăng hepcidin, một hormone ức chế hấp thu sắt, dẫn đến thiếu máu thiếu sắt dai dẳng, đặc biệt ở trẻ em và phụ nữ.
- Xuất huyết giảm tiểu cầu tự miễn (ITP): Nhiễm HP có thể kích hoạt đáp ứng miễn dịch bất thường, sản xuất kháng thể chống lại tiểu cầu, gây giảm tiểu cầu ngoại vi. Điều trị tiệt trừ HP giúp cải thiện số lượng tiểu cầu ở nhiều bệnh nhân ITP.
- Bệnh lý tim mạch: Một số nghiên cứu cho thấy HP có thể góp phần thúc đẩy xơ vữa động mạch thông qua cơ chế viêm hệ thống, tăng stress oxy hóa, rối loạn chuyển hóa lipid và tăng nguy cơ bệnh mạch vành.
- Bệnh lý thần kinh: HP liên quan đến một số bệnh thần kinh như bệnh Parkinson, Alzheimer, đau đầu mạn tính. Cơ chế có thể do viêm hệ thống, rối loạn chuyển hóa vitamin B12 hoặc tác động gián tiếp qua trục não-ruột.
- Thiếu vitamin B12: Tổn thương niêm mạc dạ dày do HP làm giảm tiết yếu tố nội tại (intrinsic factor), dẫn đến giảm hấp thu vitamin B12, gây thiếu máu hồng cầu to và các rối loạn thần kinh.
- Bệnh lý da liễu: Một số bệnh ngoài da như ban xuất huyết Henoch-Schönlein, vảy nến, viêm da cơ địa, mày đay mạn tính có thể liên quan đến nhiễm HP, thông qua cơ chế miễn dịch và viêm hệ thống.
3. Cơ chế tác động toàn thân của HP
HP không chỉ gây tổn thương tại chỗ mà còn kích hoạt phản ứng viêm hệ thống thông qua việc giải phóng các cytokine như IL-1, IL-6, TNF-α. Quá trình này làm tăng tính thấm thành mạch, rối loạn chuyển hóa lipid, tăng nguy cơ các bệnh lý chuyển hóa và tim mạch. Ngoài ra, HP còn ảnh hưởng đến hệ vi sinh vật đường ruột, làm mất cân bằng hệ vi sinh, từ đó tác động đến sức khỏe tổng thể.
4. Rối loạn chức năng tiêu hóa và hấp thu
- Rối loạn tiết acid: HP có thể gây tăng hoặc giảm tiết acid dạ dày tùy vị trí nhiễm khuẩn. Viêm hang vị thường làm tăng tiết acid, trong khi viêm thân vị gây giảm tiết acid, ảnh hưởng đến quá trình tiêu hóa và hấp thu dưỡng chất.
- Giảm hấp thu dưỡng chất: Tổn thương niêm mạc dạ dày do HP làm giảm hấp thu sắt, vitamin B12, acid folic và các vi chất khác, dẫn đến thiếu hụt dinh dưỡng kéo dài, ảnh hưởng đến sự phát triển thể chất và trí tuệ, đặc biệt ở trẻ em.
- Rối loạn vận động dạ dày: Nhiễm HP có thể gây rối loạn nhu động dạ dày, gây đầy hơi, chướng bụng, khó tiêu, buồn nôn kéo dài.
5. Các yếu tố nguy cơ và biến chứng liên quan đến vi khuẩn HP
| Yếu tố nguy cơ | Biến chứng |
|---|---|
|
|
6. Tác động lâu dài đến sức khỏe cộng đồng
Tỷ lệ nhiễm HP ở Việt Nam và nhiều nước châu Á rất cao (ước tính 60-80% dân số). Điều này làm tăng gánh nặng bệnh tật liên quan đến dạ dày, đặc biệt là ung thư dạ dày – một trong những nguyên nhân tử vong hàng đầu do ung thư. Ngoài ra, các biến chứng ngoài dạ dày như thiếu máu, bệnh lý tim mạch, thần kinh cũng ảnh hưởng lớn đến chất lượng sống và chi phí y tế.
7. Vai trò của phát hiện và điều trị vi khuẩn HP
- Phát hiện sớm: Xét nghiệm HP (test hơi thở, test urease nhanh, huyết thanh học, PCR) giúp chẩn đoán sớm, từ đó có chiến lược điều trị phù hợp, giảm nguy cơ biến chứng nặng.
- Điều trị tiệt trừ HP: Sử dụng phác đồ kháng sinh kết hợp thuốc ức chế bơm proton (PPI) giúp loại bỏ HP, làm giảm nguy cơ tái phát loét, phòng ngừa ung thư dạ dày và cải thiện các bệnh lý ngoài dạ dày liên quan.
- Kiểm soát yếu tố nguy cơ: Thay đổi lối sống, dinh dưỡng hợp lý, tránh các yếu tố nguy cơ (hút thuốc, rượu, thực phẩm lên men, nhiều muối) góp phần giảm tỷ lệ nhiễm và tái nhiễm HP.
8. Một số lưu ý chuyên sâu
- Đề kháng kháng sinh: Tỷ lệ HP kháng clarithromycin, metronidazole ngày càng tăng, gây khó khăn trong điều trị. Cần cá thể hóa phác đồ dựa trên kết quả kháng sinh đồ nếu có thể.
- Tái nhiễm HP: Tái nhiễm thường gặp ở trẻ em, người sống trong môi trường đông đúc, điều kiện vệ sinh kém. Phòng ngừa tái nhiễm là yếu tố then chốt trong kiểm soát bệnh.
- Ảnh hưởng đến hệ vi sinh vật đường ruột: Điều trị HP có thể làm thay đổi hệ vi sinh vật đường ruột, gây rối loạn tiêu hóa tạm thời. Việc sử dụng men vi sinh hỗ trợ có thể giúp cân bằng lại hệ vi sinh.
HP là một trong những tác nhân vi khuẩn có ảnh hưởng sâu rộng nhất đến sức khỏe dạ dày và toàn thân, đòi hỏi sự quan tâm đặc biệt trong phát hiện, điều trị và phòng ngừa.
Tham khảo thêm : Bài thuốc cổ truyền điều trị HP
Xu hướng nghiên cứu và ứng dụng công nghệ mới trong kiểm soát HP
Trong bối cảnh vi khuẩn Helicobacter pylori (HP) là nguyên nhân hàng đầu gây viêm loét dạ dày-tá tràng, ung thư dạ dày và các bệnh lý tiêu hóa khác, các xu hướng nghiên cứu và ứng dụng công nghệ mới trong kiểm soát HP đang được đẩy mạnh trên toàn cầu. Những tiến bộ này không chỉ tập trung vào điều trị mà còn hướng tới phòng ngừa, phát hiện sớm và giảm thiểu nguy cơ kháng thuốc. Dưới đây là các hướng nghiên cứu chuyên sâu đang được quan tâm:
- Phát triển vaccine phòng ngừa HP
Vaccine phòng ngừa HP là một trong những mục tiêu lớn của y học hiện đại nhằm kiểm soát tận gốc nguồn lây nhiễm. Hiện nay, các nghiên cứu tập trung vào cả hai dạng vaccine:
- Vaccine đường uống: Được thiết kế để kích thích miễn dịch tại niêm mạc dạ dày, nơi HP cư trú. Các thử nghiệm lâm sàng giai đoạn I và II đã ghi nhận khả năng sinh miễn dịch tốt, tuy nhiên vẫn còn thách thức về độ bền miễn dịch và hiệu quả bảo vệ lâu dài.
- Vaccine tiêm: Sử dụng các kháng nguyên tái tổ hợp hoặc peptide đặc hiệu của HP, kết hợp với tá dược tăng cường đáp ứng miễn dịch. Một số vaccine tiêm đang được thử nghiệm trên động vật và bước đầu cho kết quả khả quan về giảm tỷ lệ nhiễm mới.
Ngoài ra, các nhà khoa học còn nghiên cứu vaccine đa giá, kết hợp nhiều kháng nguyên khác nhau của HP nhằm tăng hiệu quả bảo vệ và giảm nguy cơ biến dị kháng nguyên.
- Ứng dụng công nghệ sinh học phân tử trong chẩn đoán và kiểm soát HP
Công nghệ sinh học phân tử đã mở ra kỷ nguyên mới trong phát hiện, định danh và theo dõi các chủng HP, đặc biệt là các chủng kháng thuốc. Một số ứng dụng nổi bật gồm:
- Giải trình tự gen toàn bộ (Whole Genome Sequencing - WGS): Cho phép xác định chính xác các đột biến gen liên quan đến kháng kháng sinh, phân tích nguồn gốc lây nhiễm và đánh giá đa dạng di truyền của HP trong cộng đồng.
- PCR đa mồi (Multiplex PCR): Phát hiện đồng thời nhiều gen đích, bao gồm gen kháng thuốc (như 23S rRNA, gyrA, rdxA), giúp xác định nhanh chủng HP kháng clarithromycin, levofloxacin, metronidazole... trong vòng vài giờ.
- Phân tích proteomics và transcriptomics: Nghiên cứu biểu hiện protein và RNA của HP trong các điều kiện khác nhau, từ đó phát hiện các dấu ấn sinh học mới phục vụ chẩn đoán sớm và cá thể hóa điều trị.
Những tiến bộ này giúp rút ngắn thời gian chẩn đoán, tăng độ chính xác và hỗ trợ lựa chọn phác đồ điều trị tối ưu, hạn chế tình trạng kháng thuốc lan rộng.
- Phát triển kháng sinh thế hệ mới và liệu pháp thay thế
Sự gia tăng các chủng HP kháng đa thuốc là thách thức lớn đối với điều trị hiện nay. Các hướng nghiên cứu nổi bật bao gồm:
- Phát triển các phân tử nhỏ (small molecules): Nhắm vào các enzyme thiết yếu của HP như urease, DNA gyrase, hoặc các yếu tố độc lực, nhằm ức chế chọn lọc sự phát triển của vi khuẩn mà không ảnh hưởng đến hệ vi sinh vật có lợi.
- Peptide kháng khuẩn (antimicrobial peptides - AMP): Các peptide tổng hợp hoặc có nguồn gốc tự nhiên, có khả năng phá vỡ màng tế bào HP, ít gây kháng thuốc và độc tính thấp đối với tế bào người.
- Liệu pháp phage (bacteriophage therapy): Sử dụng virus chuyên biệt tấn công HP, tiêu diệt vi khuẩn mà không ảnh hưởng đến các vi khuẩn khác trong dạ dày. Một số nghiên cứu đã phân lập được phage đặc hiệu với HP, mở ra hướng điều trị mới cho các trường hợp kháng đa thuốc.
Ngoài ra, các nhà khoa học còn nghiên cứu phối hợp các hoạt chất tự nhiên (polyphenol, flavonoid, tinh dầu thảo dược) với kháng sinh truyền thống để tăng hiệu quả diệt HP và giảm tác dụng phụ.
- Liệu pháp vi sinh và cân bằng hệ vi sinh dạ dày
Hệ vi sinh vật dạ dày đóng vai trò quan trọng trong kiểm soát sự phát triển của HP cũng như duy trì sức khỏe tiêu hóa. Các hướng ứng dụng nổi bật:
- Probiotic: Chủng Lactobacillus, Bifidobacterium, Saccharomyces boulardii... được chứng minh có khả năng ức chế sự bám dính và phát triển của HP, giảm viêm niêm mạc dạ dày, đồng thời hạn chế tác dụng phụ của kháng sinh như tiêu chảy, loạn khuẩn.
- Prebiotic: Các chất xơ hòa tan, oligosaccharide giúp nuôi dưỡng lợi khuẩn, tăng sức đề kháng tự nhiên của niêm mạc dạ dày đối với HP.
- Synbiotic: Kết hợp probiotic và prebiotic nhằm tối ưu hóa hiệu quả cân bằng hệ vi sinh, hỗ trợ phòng ngừa tái nhiễm HP sau điều trị.
Một số nghiên cứu còn tập trung vào việc xác định các chủng vi sinh vật bản địa có khả năng cạnh tranh với HP, từ đó phát triển các chế phẩm sinh học đặc hiệu cho từng nhóm bệnh nhân.
So sánh các xu hướng nghiên cứu kiểm soát vi khuẩn HP
| Hướng nghiên cứu | Ưu điểm | Thách thức |
|---|---|---|
| Vaccine phòng ngừa HP | Phòng ngừa chủ động, giảm tỷ lệ nhiễm mới, hiệu quả lâu dài | Độ bền miễn dịch chưa rõ, khó phát triển vaccine hiệu quả do đa dạng chủng HP |
| Công nghệ sinh học phân tử | Chẩn đoán nhanh, chính xác, phát hiện kháng thuốc sớm | Chi phí cao, yêu cầu trang thiết bị hiện đại, chuyên môn kỹ thuật cao |
| Kháng sinh thế hệ mới & liệu pháp thay thế | Giải quyết vấn đề kháng thuốc, đa dạng hóa lựa chọn điều trị | Chưa có nhiều sản phẩm thương mại hóa, cần nghiên cứu thêm về an toàn và hiệu quả |
| Liệu pháp vi sinh | An toàn, hỗ trợ điều trị, giảm tác dụng phụ, phòng ngừa tái nhiễm | Hiệu quả còn phụ thuộc vào từng cá thể, cần xác định chủng vi sinh phù hợp |
Xu hướng tích hợp đa công nghệ trong kiểm soát vi khuẩn HP
Các nghiên cứu hiện đại đang hướng tới tích hợp đa công nghệ trong kiểm soát HP, kết hợp giữa chẩn đoán phân tử, cá thể hóa điều trị, sử dụng probiotic và phát triển vaccine. Việc này không chỉ giúp nâng cao hiệu quả kiểm soát HP mà còn giảm thiểu nguy cơ kháng thuốc, bảo vệ hệ vi sinh vật có lợi và nâng cao chất lượng sống cho bệnh nhân.
Một số dự án quốc tế còn ứng dụng trí tuệ nhân tạo (AI) trong phân tích dữ liệu di truyền, dự báo nguy cơ kháng thuốc và tối ưu hóa phác đồ điều trị cá thể hóa cho từng bệnh nhân nhiễm HP.
Tham khảo:
Những tiến bộ này hứa hẹn mở ra các giải pháp kiểm soát HP hiệu quả, an toàn và bền vững hơn trong tương lai.